Ассоциация - вода
Cтраница 2
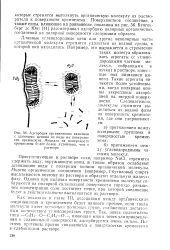 |
Адсорбция органических катионов с длинными цепями из воды на поверхности кремнезема. Мицелла на поверхности кремнезема будет более устойчива, чем в растворе. [16] |
Присутствующие в растворе соли, например NaCl, стремятся удержать воду, окружающую ионы, и таким образом ослабляют ассоциацию воды с полярным концом органической молекулы. Многие органические соединения ( например, f - бутиловый спирт) высаливаются поэтому из раствора и образуют отдельную жидкую фазу. Однако при наличии поверхности кремнезема молекулы собираются на полярной силанольной поверхности гораздо раньше, чем концентрация соли достигнет точки, при которой соединение будет в действительности высаливаться из раствора. [17]
Наряду с изменением энтальпии, наблюдающимся для реакции в газовой фазе, необходимо учитывать теплоты гидратации обоих комплексов и лигандов и теплоту ассоциации воды. При измерении теплот этих реакций мы в действительности определяем разность в энергиях связи у комплексов с координированными молекулами воды и у комплексов с координированными лигандами. Таким образом, для оценки энергии связи металл - лиганд необходимо знать теплоты гидратации газообразных ионов металла и других частиц, участвующих в реакции. Обычно эти величины известны, или могут быть в большинстве случаев установлены. [18]
Наряду с изменением энтальпии, имеющим место для реакции Е газовой фазе, необходимо учитывать теплоты гидратации обоих комплексов и лигандов и теплоту ассоциации воды. При измерении теплот этих реакций мы в действительности опреде ляем разность в энергиях связи у комплексов с координирован ными молекулами воды и у комплексов с координированными лигандами. Таким образом, для оценки энергии связи металл - лиганд необходимо знать теплоты гидратации газообразных ионов металла и других частиц, участвующих в реакции. Обычно этit - величины известны, или могут быть в большинстве случаев уста новлены. [19]
Наряду с изменением энтальпии, имеющим место для реакции в газовой фазе, необходимо учитывать теплоты гидратации обоих комплексов и лигандов и теплоту ассоциации воды. При измерении теплот этих реакций мы в действительности опреде ляем разность в энергиях связи у комплексов с координированными молекулами воды и у комплексов с координированными лигандами. Таким образом, для оценки энергии связи металл - лиганд необходимо знать теплоты гидратации газообразных ионов металла и других частиц, участвующих в реакции. Обычно эти величины известны, или могут быть в большинстве случаев уста новлены. [20]
Наряду с изменением энтальпии, имеющим место для реакции ь газовой фазе, необходимо учитывать теплоты гидратации обоих комплексов и лигандов и теплоту ассоциации воды. При измерении теплот этих реакций мы в действительности опреде ляем разность в энергиях связи у комплексов с координирован ными молекулами воды и у комплексов с координированными лигандами. Таким образом, для оценки энергии связи металл - лиганд необходимо знать теплоты гидратации газообразных ионоь металла и других частиц, участвующих в реакции. Обычно эти величины известны, или могут быть в большинстве случаев уста новлены. [21]
В этих реакциях наряду с изменением энтальпии, наблюдающимся для реакции в газовой фазе, необходимо учитывать также теплоты гидратации обоих комплексов и лигандов и теплоту ассоциации воды. [22]
 |
Температурная зависимость предельного напряжения сдвига TQ. [23] |
Интересно отметить, что характер температурной зависимости т0 ( Г) для воды ( рис. III.13), полученный в наших опытах, совпадает с характером температурной зависимости ассоциации воды [213] и изменением интенсивности полосы ассоциатов в ИК-спектре и в спектре КР - Так, в ИК-спектре растворов бензилового спирта в ССЦ при температуре 11 С наиболее интенсивна полоса поглощения с максимумом около 3 0 мкм, которая принадлежит ОН-груп-пам, участвующим в Н - связи. [24]
Водородная связь обозначена точками. Высокая степень ассоциации воды, спирта и аммиака обусловлена не только полярностью их молекул, но и содержанием у воды и спирта водорода при гидроксильной группе, способного к образованию водородной связи и атома кислорода той же группы, легко связывающегося с соответствующим водородным атомом другой молекулы. Атом азота аммиака способен связываться с водородом такой же связью. Жидкости, которые проявляют полярные свойства, но неспособны к образованию водородной связи, обычно ассоциированы в слабой степени. [25]
Водородная связь обозначена точками. Высокая степень ассоциации воды, спирта и аммиака обусловлена не только полярностью их молекул, но и наличием у воды и спирта водорода при гидро-ксильной группе, способного к образованию водородной связи и атома кислорода той же группы, легко связывающегося с соответствующим водородным атомом другой молекулы. Атом азота аммиака способен связываться с водородом такой же связью. Жидкости, которые проявляют полярные свойства, но неспособны к образованию водородной связи, обычно ассоциированы в слабой степени. [26]
Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения. Способность спиртов, аминов, карбо-новых кислот растворяться в воде вызвана образованием водородных связей с молекулами воды. [27]
Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и их аномально высокие температуры кипения сравнительно, например, с сероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде обусловлена образованием водородных связей с водой. [28]
Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения сравнительно, например, с сероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде вызвана образованием водородных. [29]
Наличие водородных связей оказывает существенное влия-ние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения сравнительно, - например, с сероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде ызвана образованием водородных связей с молекулами воды. [30]
Страницы: 1 2 3 4