Разрыхление - решетка
Cтраница 3
Если возбужденный уровень центра захвата близок к зоне проводимости, а температура опыта не слишком низка, то энергия активации, требуемая для перевода центра в возбужденное состояние, может оказаться достаточной и для его ионизации. Ионизовать центры окраски щелочно-галоидных кристаллов только путем нагревания не удается из-за большой глубины центров, требующей температуры, значительно превышающей температуру разрыхления решетки ( см. гл. [31]
Переход к сесквисульфиду галлия связан с некоторым затруднением передачи валентных электронов галлия сере из-за разных энергетических уровней валентных электронов. Это сказывается в меньшей локализации валентных электронов галлия у атомов серы и в более низкой температуре плавления ( около 1000 С) вследствие несколько большего разрыхления решетки. [32]
 |
Дислоцированные атомы ( / и вакантные узлы ( 2 в кристаллической решетке. [33] |
Чтобы перейти из одного узла решетки в другой, атом должен преодолеть определенный энергетический барьер, зависящий от энергии связи в кристалле. Переход атомов при тепловом движении из одних положений равновесия в другие называется самодиффузией, а минимальная энергия, необходимая для этого перехода, называется энергией активации при самодиффузии, или энергией разрыхления решетки. [34]
Подъем на кривой / между 200 и 400 С Либер относит за счет образования пористой кристаллической решетки в результате потери 2 мслекул воды. Дальнейн ий подъем, который начинается примерно при 400 С и достигает максимума при 540 С, Либер объясняет переходом от перистой к нсрмалы-юй кристаллическсй структуре, который становится возможным благодаря разрыхлению кристаллическсй решетки при температурах, превын ающих 400 С. Изменение хода кривой, наблюдаемое между 800 и 900 С, Либер никак ке объясняет, а появление пика при 925 С она приписывает переходу от а - ( моноклинической) к - ( кубической) форме хлорида бария, который происходит в непосредственной близости от температуры плавления. [35]
Второй этап - разрыхление решетки после предельного упрочнения, и, наконец, третий этап - образование трещины усталости в зоне разрыхления и дальнейший рост этой трещины за счет концентрации напряжений в ее тупиковой части. [36]
На скорость процесса газификации ( образования окиси углерода) большое влияние оказывает реакционная способность углей. Наличие в реакционной зоне окислов шелочных и щелочноземельных металлов ускоряет этот процесс. Это объясняется 14 разрыхлением решетки углеродистого материала, в результате чего возрастает его реакционная способность. Таким образом, принципиальной разницы между восстановлением окислов железа газообразными и твердыми восстановителями нет. В обоих случаях восстановление протекает по адсорбционно-каталитическому механизму, хотя каждый из этих способов имеет свои особенности. Порошки, обладающие хорошими электрохимическими характеристиками, получаются восстановлением сажей с добавкой едкого натра, при температуре 800 - 900 С. [37]
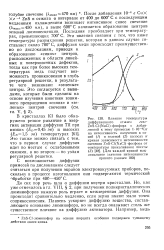
При получении поликристаллических люминофоров характерная для них люминесценция появляется лишь при термической обработке шихты выше определенной температуры ( см. рис. 130), зависящей в основном от природы основания люминофоров. По данным Н. И. Ивановой и Ф. Д. Клемента [50, 57], исследовавших преимущественно активированные примесями широкозонные кристалло-фосфоры, температура, отвечающая середине интервала наиболее резкого возрастания интенсивности свечения, называемая ими температурой возникновения фосфора ( Тъ), составляет в среднем 0 52 от температуры плавления основания люминофора. Это довольно близко к температуре разрыхления решетки, обнаруживаемой по спеканию порошка. Та же закономерность наблюдается и у суль-фидных люминофоров. Например, при прокаливании с хлористым натрием в качестве плавня величина ТВ, как и Гра3р, для ZnS-фос-форов составляет около 700 С при активации примесями ZnCb, AgCl и CuCl. Для CdS-фосфоров обе величины снижаются примерно до 500 С. [38]
Необходимостью растворения активирующей примеси в основании люминофора для возникновения способности к люминесценции обусловлена в значительной мере и существующая связь между температурой возникновения фосфора и температурой разрыхления решетки. Следовательно, необходимость достичь температуры, при которой начинается разрыхление решетки, связана не только с диффузией активатора. [39]
После добавления 10 - 4 г СиХ Хг - 1 ZnS и отжига в интервале от 400 до 600 С с последующим медленным охлаждением возникает интенсивное синее свечение ( имакс 450 нм), а выше 600 С начинается образование центров зеленей люминесценции. Последняя преобладает при температурах, превышающих 700 С. Эти явления связаны с тем, что ниже температуры разрыхления решетки, которая в данном случае составляет около 700 С, диффузия меди происходит преимущественно по дислокациям, приводя к образованию синих центров, расположенных в области линейных и поверхностных дефектов, тогда как при более высоких температурах медь получает возможность проникновения в глубь регулярной решетки, в результате чего возникают зеленые центры. Это согласуется с выводами, которые были сделаны на основе изучения кинетики взаимного превращения синих и зеленых центров свечения ( см. гл. [41]
Диффузионные процессы сильно ускоряются при температурах, близких к температурам фазовых превращений. Например, диффузионная подвижность углерода и самодиффузия атомов железа резко возрастают при циклическом нагреве несколько выше и ниже эвтектоидной температуры. Это, вероятно, связано с тем, что при температурах фазового превращения имеет место разрыхление решетки и накопление дислокаций, облегчающих процессы диффузии. Однако большую диффузионную подвижность углерода в а-фазе благодаря малой его растворимости в феррите трудно использовать при упрочнении изделий цементацией. [42]
При действии на металл среды в атомарном или ионном состоянии наблюдается наибольшее снижение поверхностной энергии. Активные компоненты среды, имея малые размеры, свободно диффундируют в решетку металла и создают блокирующие дислокации облака Котрелла, тем самым охрупчивая материал. Этому содействует продвижение путем нерегулярной диффузии активных компонент среды к вершинам зарождающихся трещин, что вызывает разрыхление решетки металла в связи с его хемоактивацией под влиянием концентрации деформации в этом месте. [43]
Это указывает на то, что хемосорбированный кислород разрыхляет поверхность и поэтому уже при низких температурах обеспечивает интенсивную поверхностную диффузию атомов меди. Адсорбированный водород, который значительно слабее адсорбирован на меди, имеет лишь очень низкую тенденцию к разрыхлению решетки, что выражается в более высокой энергии активации процесса диффузии. [44]
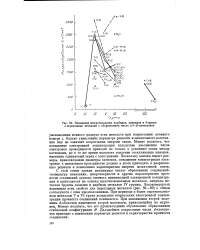 |
Изменение микротвердости карбидов, нитридов и боридов d - переходных металлов с возрастанием числа ( s й - электронов. [45] |
Страницы: 1 2 3 4